|
La lumière c'est de l'énergie éléctromagnétique émise ou absorbée par un atome sous forme de "paquets" qu'on appelle photons.
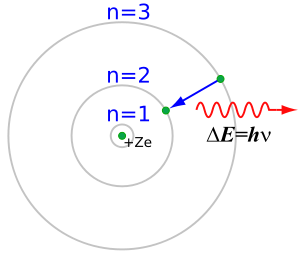
Dans un atome des électrons sont en orbite autour du noyau. A chaque orbite correspond une énergie différente. Seules certaines orbites sont permises: c'est la quantification. Les électrons ayant le plus d'énergie sont sur des orbites hautes (les plus lointaines du noyau).
(Image Wikipedia)
Quand un électron passe d'une orbite haute à une orbite basse, la différence d'énergie entre les deux orbites est émise sous forme d'un photon.
Quand un électron fait la transition inverse (orbite basse à orbite haute), il y a absorption d'un photon de la même énergie.
C'est Niels Bohr (1885-1962) qui a développé en 1913 la théorie de la structure atomique en suivant les premiers travaux de Ernest Rutherford (1871-1937).
La nature discrète de la lumière émise par un gaz, sous forme de photons à certaines longueurs d'onde, est la conséquence directe sa structure atomique quantifiée.
C'est pourquoi chaque élément chimique émet (ou absorbe) seulement des photons dont les énergies lui sont caractéristiques (son empreinte digitale).
Elles correspondent aux transitions entre les différentes orbites possibles des électrons qui lui sont associés. On connaît 117 éléments chimiques, dont 94 existent à l'état naturel sur Terre. | 
